3项瑞德西韦研究同一天发布!研究结果令人困惑(组图)
一天之内,瑞德西韦的 3 项重要研究同时揭晓,然而结论却令人困惑。
4 月 29 日,美国吉利德公司官网发布信息称,在一项开放标签的3期试验中,新冠重症患者显示出临床改善,且越早接受瑞德西韦治疗的患者临床改善情况越好。
美国国立卫生研究院(NIH)网站同日公布消息称,一项 1063 名患者的随机对照试验的初步数据分析显示,重症患者中瑞德西韦组的康复速度快于安慰剂组。
而知名医学期刊《柳叶刀》则同日发表来自中国的研究显示,这项 237 名重症患者的随机对照研究显示,瑞德西韦组患者的临床获益与安慰剂组比较没有统计学意义,没有降低病死率。这正是此前世界卫生组织泄露数据所得出的结论。
图 | 新冠病毒电子显微镜照片。(来源:NIH)
全球 6 项瑞德西韦研究已经有了 3 个结果,如何解读呢?中国研究项目的负责人曹彬在接受DeepTech采访时称,中国研究和NIH研究不可比较,本质上是两个不同的研究。
中国研究样本不足
早在世卫组织泄露的数据中就显示,在这项中国研究中,2 月 6 日到 3 月12 日有 237 名新冠肺炎确诊患者参与了该临床试验,其中 158 名患者进入瑞德西韦试验组,79 人在对照组,对于重症患者,接受瑞德西韦的试验组病死率为 13.9%,而接受标准治疗的对照组为 12.8%,两者差异无统计学意义。
《柳叶刀》的论文结论与世卫组织数据结论一致,即与安慰剂相比,重度患者的静脉瑞德西韦不能显著改善临床改善时间,死亡率或清除病毒的时间。不过,对于发病在 10 天及以内的患者,瑞德西韦组的临床起效时间表现要优于安慰剂组。
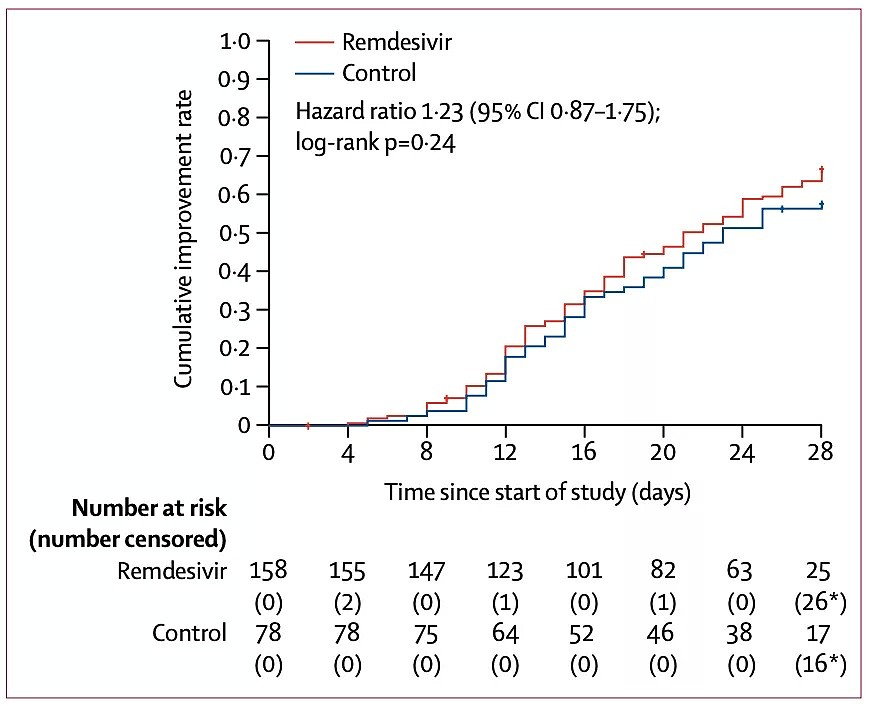
图 | 中国试验中,瑞德西韦表现并不显著。(来源:柳叶刀)
《柳叶刀》发表的这项研究题为《瑞德西韦的成人新冠重症研究:一项随机、双盲、安慰剂对照的多中心试验》。通讯作者是中日友好医院副院长曹彬和中国工程院副院长、呼吸与危重症医学专家王辰。
按照最初的设计,在中国的重症患者临床试验计划招募 453 名患者,他们在出现新冠肺炎症状的 12 天内开始接受双盲试验,进行为期 10 天的韦德西韦药物治疗或安慰剂治疗。
试验方案分为试验组和对照组。试验组患者入组第 1 天给予瑞德西韦 200 毫克负荷剂量,之后每天静脉注射 100 毫克,持续治疗 9 天;对照组患者入组第 1 天给予安慰剂 200 毫克,之后每天静脉注射 100 毫克,持续治疗 9 天。主要结局指标是 28 天内的临床改善时间。
研究是在湖北省的 10 家医院进行的,试验由合同研究组织( CRO)杭州泰格医药科技股份有限公司监控。由于 3 月 12 日之后没有适合标准的新患者入组,数据与安全监察委员会(DSMB)建议根据临床试验方案的标准而中止了本项临床试验,并于 3 月 29 日揭盲开始了最后的统计分析。
在 155 名瑞德西韦组患者中,有 5 人用药时间不超过 5 天。安慰剂组中有 2 人用安慰剂不超过 5 天。
瑞德西韦组中,患者中位年龄 65 岁,男性 56%,女性 44%。安慰剂组中男性 65%,女性 35%。最常见的合并症是高血压,其次是糖尿病和冠心病。在住院期间,有 155 名患者(66%)接受了皮质类固醇激素治疗,18% 的受试者在入组前服用了匹那韦–利托那韦。最终随访时间为 2020 年 4 月 10 日。
有 102 名用药组患者发生了不良反应事件,占比 66%,其中 18 例中止了用药,而 50 名对照组有不良反应,占比 64%。
两组的 28 天死亡率相似,瑞德西韦组 22 例死亡,占比 14%,安慰剂组 10 例,占比 13%。现场研究人员的结论是,观察期内所有死亡均与瑞德西韦干预措施无关。
作者分析认为,与此前瑞德西韦同情用药情况相比,本来是预期此次研究有更加积极结果的,因为此次研究介入时间更早,且从氧气治疗措施看,入组患者症状更轻一些。
北京大学第一医院医学统计室主任姚晨认为,瑞德西韦被国内舆论称为“人民的希望”,这或可能带来期望偏信。曹彬的研究在全球首次采用了随机双盲、安慰剂对照设计,保障了试验结果科学性和可靠性,可有效避免来自研究者和受试者因对瑞德西韦期望所产生的各种偏倚,同时也为了更好地控制临床试验期间其它治疗措施的影响。他同时也是中国研究的数据与安全监察委员会成员。
姚晨告诉 DeepTech,如果招募到计划中 453 名患者的话,曹彬试验的统计功效为 80%,而 237 名患者入组让统计功效降到了 58%,这就意味着其研究说服力有所下降。
姚晨说,曹彬的研究是“第一个吃螃蟹”的瑞德西韦研究,试验设计很有挑战性,一些参数如指标改善时间不确定,只能估计。
有业内看法称,该研究的结论并不意味瑞德西韦无效,其研究价值主要体现在这个设定的目标人群中未达到预期的临床效果,其有效性的确定需要多个临床试验的验证。
对于曹彬等人的研究,纽约时报引述杜克大学医学中心教授埃里克·彼得森(Eric Peterson)看法称,中国研究的入组人数太少,不过如果瑞德西韦是特效药,也应该在此研究中显示出来。他认为,瑞德西韦应该用于轻症患者,
斯坦福大学全球卫生专家米歇尔·巴里(Michele Barry)则称,中国研究有样本不足的缺陷,不过如果在研究中使用高剂量或更早给药,可能会有不一样的结果。
这与曹彬等人在论文中的看法接近,他们认为,由于入组患者不足,那么这项研究就不能充分评估瑞德西韦在早期介入的临床获益情况。同时,此前的老鼠研究和灵长类研究显示,瑞德西韦的干预应该在感染早期,而武汉的研究中由于当时床位紧张,大量患者入组时已经较晚,这些都可能影响了研究结论。
美国研究的结论为何?
根据美国国立卫生研究院(NIH)官网消息,国家过敏症和传染病研究所(NIAID)这项研究结论来自 1063 名患者,是一项随机对照试验研究。这也是美国发起的第一项重症患者研究项目。
数据与安全监察委员会在 4 月 27 日进行了中期分析,结论是从主要结局指标看,瑞德西韦组的患者康复更快。接受瑞德西韦治疗的患者中位恢复时间为 11 天,而接受安慰剂的患者为 15 天。
对于病死率的比较,瑞德西韦组的病死率为 8.0%,而安慰剂组的病死率为 11.6%。
该试验的第一位受试者是一名钻石公主号游轮上的美国人,他自愿在布拉斯加大学医学中心参加试验。最终这项研究囊括了 68 个研究中心,其中美国有 47 个,欧洲和亚洲国家有 21 个。试验已经于 4 月 19 日停止患者招募。
白宫首席传染病专家、国家过敏症与传染病研究所所长安东尼·福奇(Anthony Fauci)对瑞德西韦表示看好。据纽约时报报道,他说,美国研究证明了瑞德西韦可以阻断病毒侵袭人体,可以帮助重症患者更快康复。
福奇说,NIH 这项研究中,瑞德西韦组病亡率较低,但没有显著统计学意义,不过这不是该研究的主要评价指标。
曹彬在接受 DeepTech 采访时认为,中美两国试验差异的主要原因在于研究终点的设置不同。
曹彬说,两者在本质上是不同的研究。”我们的结局评价是一个综合指标,打个比方就像考大学要看综合表现一样,更全面、更充分“;NIH 研究对康复划定的标准不适用于中国,比如住院无需吸氧即可作为康复标准之一,这在中国则不可行。
曹彬说,尽管 NIH 研究有上千样本,但因其没有经过同行评议,目前病人年龄、轻重症比例、从入组到用药的时间是多少天、病人随访时间等数据缺失,在这个意义上,这两项研究目前也是不能比较的。中国研究经过了非常严格的研究质量控制,提交到严格的医学期刊经过顶尖专家放大镜式的评议,“你有一点瑕疵,他都给你无限地放大”。
吉利德公布的这项研究则是开放标签的随机试验,是一项 5 天和 10 天疗程的比较,没有安慰剂对照,共有 397 名重症患者入组。
结果显示,两个组临床结局没有显著差异,但在治疗后第 14 天评价看,发病 10 天内接受治疗的患者有 62% 出院,发病 10 天以上接受治疗的患者 49% 出院。也就是说,瑞德西韦更早介入会表现更好。
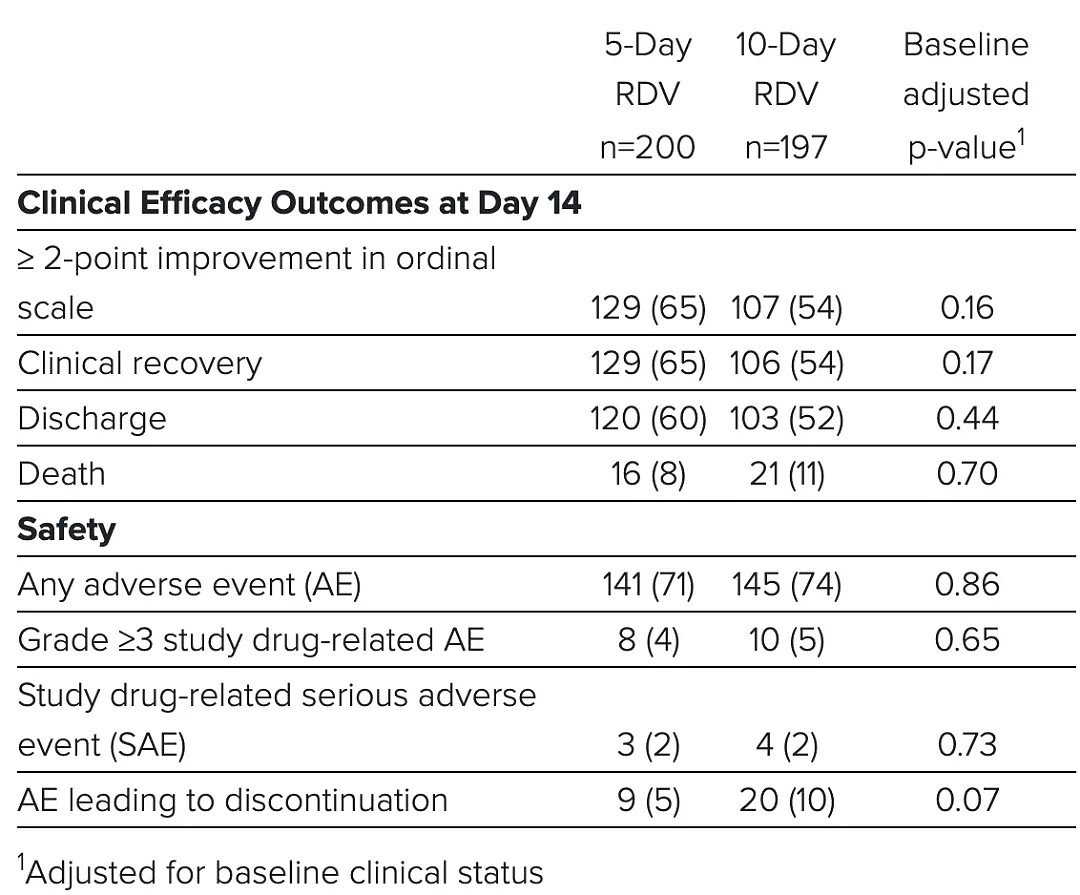
图 | 吉利德的研究结论:5 天疗程和 10 天疗程没有明显差异(来源:吉利德)
按照该临床研究的首席研究员之一、斯坦福大学医学院教授阿鲁纳·苏巴拉曼(Aruna Subramanian)的说法,该研究的主要积极意义在于可优化瑞德西韦治疗方案,即将临床病程缩短,因为 5 天疗程和 10 天疗程没有明显差异。
据悉这只是吉利德这项研究的初步结果。按照计划,该研究将招募 5600 名患者,在全球 180 个试验中心进行研究。
吉利德公司的研究仅仅是剂量研究,而非药效试验。美国南卡罗来纳医科大学公共卫生系教授赵文乐在接受 DeepTech 采访时表示,吉利德公司发表的是商业信息,并不是完整的研究结果。其开放性试验仅比较用药的剂量,跟其它两项双盲随机对照试验不同,“彼此不存在直接的可比性”。
姚晨告诉 DeepTech,没有安慰剂对照的研究就没有多少说服力,因为在治疗中会有太多干扰因素。
如果没有设立对照组,即使在一个药物治疗之后有 80% 患者康复,也不能说明该药物有效。曹彬也在一次直播节目中表示,只有安慰剂对照,才能有效地避免研究者的主观性;如果不设盲,就容易误把病人的疗效归功于研究成果,把病人的恶化归咎于疾病的进展。
美国 FDA 或紧急批准瑞德西韦
最新的消息称,美国 FDA 可能会紧急批准瑞德西韦的临床使用。据纽约时报和 CNN 称,FDA 官员正在和吉利德商谈将瑞德西韦提供给临床患者。截至 4 月 30 日,美国新冠肺炎病亡人数已经超过 6 万,确诊超过 105 万。
曾长期担任美国 FDA 新药审评员的思路迪医药首席执行官龚兆龙认为,这个审批可能是有条件批准,也“应该会批”。
福奇承认 NIH 的结果还需要同行评议,不过他看好瑞德西韦成为新冠药物。华尔街日报引述加州大学戴维斯分校重症监护医生蒂莫西·艾伯森(Timothy Albertson)看法称,生存率是重症监护中很重要的一个指标,目前瑞德西韦治疗尚未实现这一目标,不过让患者早日康复也是很积极的试验结果了。
纽约时报引述前美国心血管疾病学会 (ACC) 主席、克利夫兰临床中心史蒂文·尼森(Steven Nissen)批评称,这项研究尚未公开数据,在没有同行评议的前提下,在政治背景下公开试验结果是非常做法,科学家需要看到数据而不是如此草率地发表评论。
曹彬也认为,“他们稍微有点急,至少应该把研究做完,踏踏实实的把所有的数据都核准、再经过严格的同行评议完了之后再发布”。
CNN 则引述世界卫生组织专家玛利亚·范·科克霍夫(Maria van Kerkhove)的说法称,现在对瑞德西韦下结论为时尚早,世卫组织通常会收集多项研究来进行审查。
曹彬等人在《柳叶刀》论文中建议,需要进一步瑞德西韦用于早期发病患者和高剂量研究,以及与其他抗病毒药物或抗体药物联合用药的研究。吉利德发布消息的时间点让一些业内人士心生疑问:为何三项研究会同一天发布?有看法称,吉利德可能是提前获悉中国研究即将在《柳叶刀》刊发,于是选择抢先发布或可冲淡中国研究非积极结论的负面影响。
至少从吉利德目前股市表现看,该公司是 4 月 29 日瑞德西韦研究新闻的获益者:当天吉利德发布消息后,盘中大涨超过 8%,市值超过千亿美元。











 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


